हुण्ड का नियम (Hund’s Principal)
हुण्ड के नियमानुसार ” परमाणु कक्षकों में इलेक्ट्रॉन पहले एक – एक करके भरते है और यदि फिर इलेक्ट्रॉन बचते है तो उन एक – एक इलेक्ट्रॉन का युग्मन यानि Double करते है ।”
किसी कक्षक में इलेक्ट्रॉन तब तक युग्मित (Double) नहीं होते है जब तक कि उसके प्रत्येक कक्षक में एक – एक इलेक्ट्रॉन नहीं भर जाता है।
आपको अच्छी तरह समझाने के लिए हम P- उपकोश के कक्षकों में इलेक्ट्रॉनों का वितरण कैसे करते है उपरोक्त चित्र के माध्यम से समझने का प्रयास करेंगे –
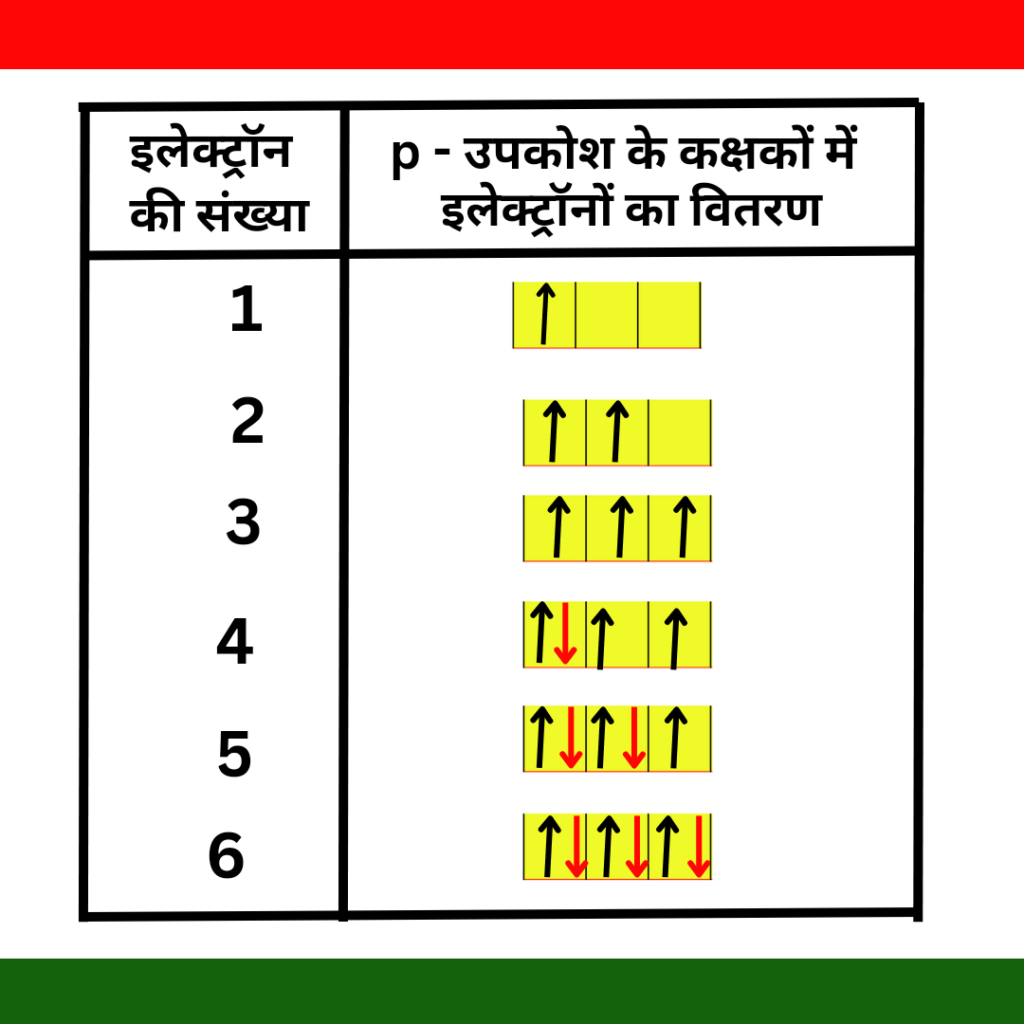
जैसा कि आप चित्र में देख सकते हो कि जब P- उपकोश में चौथे इलेक्ट्रॉन के भरने पर युग्मन प्रारम्भ होता है वैसे आप इस टेबल के द्वारा आसानी से समझ गए होगें।
प्रश्न 1. यदि किसी p – उपकोश में 3 इलेक्ट्रॉन है तो उनका विवरण बताइए
उत्तर – : p – उपकोश के तीन कक्षको में इलेक्ट्रॉन का वितरण इस प्रकार होगा –
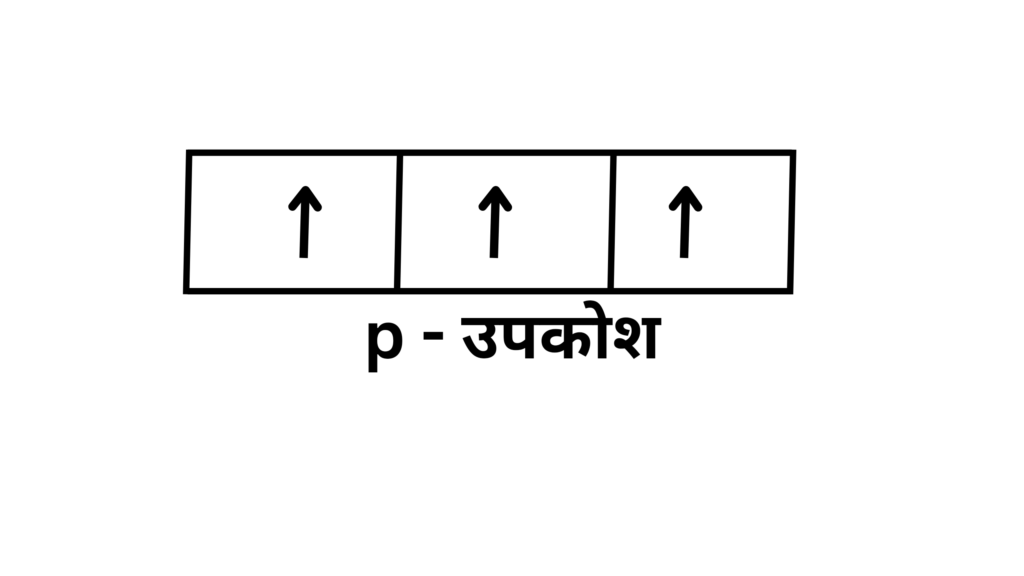
p – उपकोश के प्रत्येक कक्षक में 1 इलेक्ट्रॉन रहेगा तथा तीनों अयुग्मित इलेक्ट्रॉनों के स्पिन समदिश होगें ।
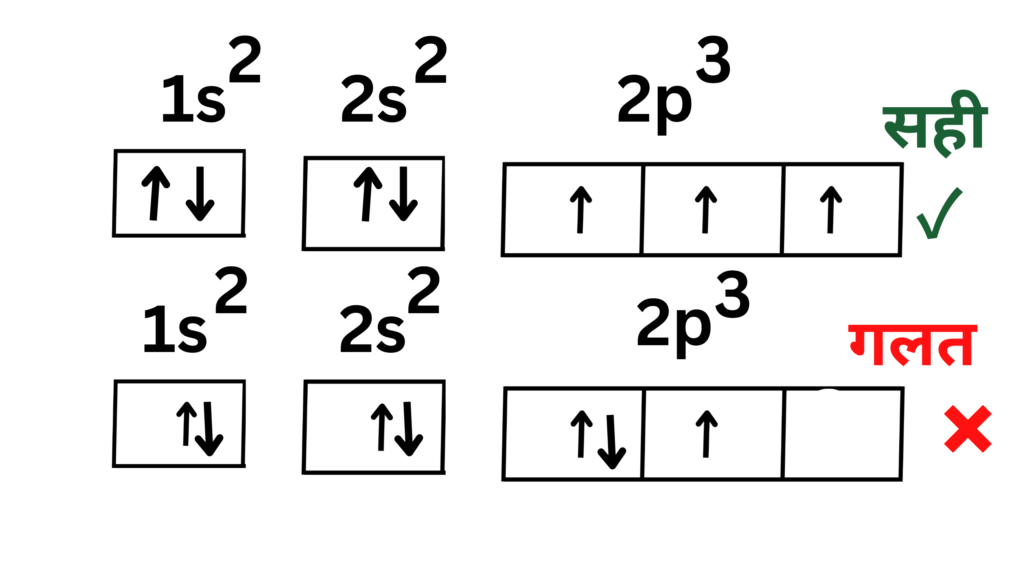
प्रश्न 2 . नाइट्रोजन तत्व में P – उपकोश मे इलेक्ट्रॉनों का वितरण बताइए ।
नाइट्रोजन तत्व का आद्य अवस्था में इलेक्ट्रॉनिक विन्यास है-
N (7) : 1s2,2s2,2p3
नाइट्रोजन के P- उपकोश में 3 इलेक्ट्रॉन हैं जिनका तीन P – कक्षकों में वितरण दो प्रकार से हो सकता है जैसा कि नीचे प्रदर्शित हैं।
Mujhe chemistry ka note’s chhaiye