बोर का परमाणु मॉडल को समझने से पहले हम परमाणु को समझते है कि परमाणु क्या है ?
किसी पदार्थ का वह छोटा-से-छोटा कण जो किसी रासायनिक अभिक्रिया में भाग ले सके अथवा रासायनिक अभिक्रिया द्वारा अलग किया जा सके, उस कण को परमाणु (Atom) कहते हैं।
उदाहरण : हाइड्रोजन (H), नियॉन (Ne), आर्गन (Ar), लोहा (Fe), कैल्शियम (Ca) आदि ।
बोर का परमाणु मॉडल ~ Bohr’s Atomic Model
रदरफोर्ड के परमाणु मॉडल की कमियों को दूर करने तथा हाइड्रोजन के परमाणु स्पेक्ट्रम की रेखाओं के स्पष्टीकरण हेतु सन् 1913 में नील्स बोर (Niels Bohr) ने प्लांक के क्वाण्टम सिद्धान्त पर आधारित एक मॉडल प्रस्तुत किया जिसके अनुसार निम्नलिखित अभिकल्पनाएं प्रस्तुत की –
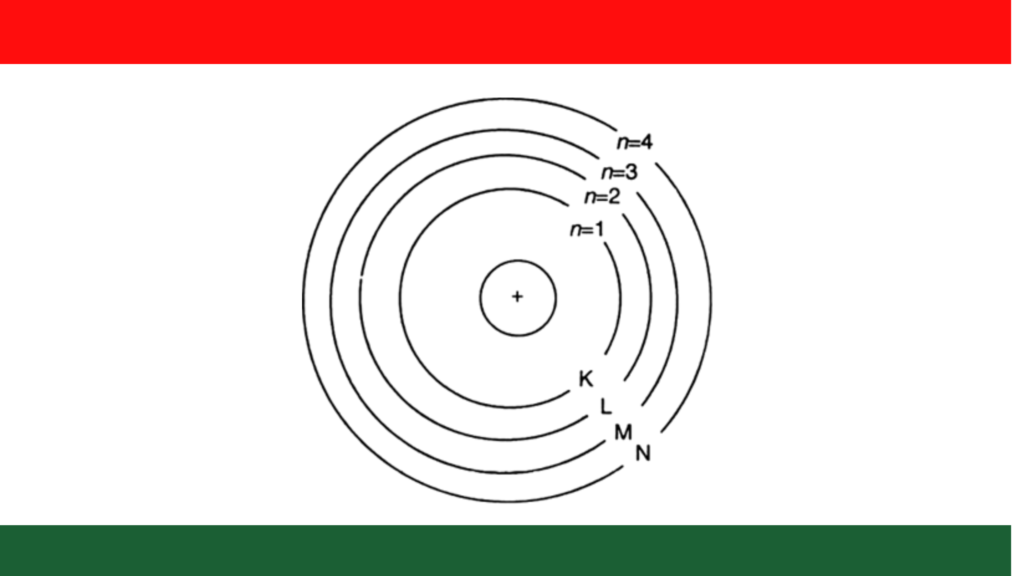
- परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर उपस्थित निश्चित त्रिज्या वाली वृत्ताकार कक्षाओं में घूमते रहते है।
- परमाणु नाभिक के चारों ओर अनेक वृत्ताकार कक्षाएं सम्भव है, लेकिन इलेक्ट्रॉन इन सभी सम्भव कक्षाओं में नहीं घूमते इलेक्ट्रॉन केवल निश्चित कक्षाओं में बिना ऊर्जा का उत्सर्जन अथवा बिना ऊर्जा नष्ट किए घूमते है ।
- परमाणु में इलेक्ट्रॉन केवल उन्ही कक्षाओं में घूमते हैं जिनमें उनका कोणीय संवेग h/2¶ का पूर्ण गुणित (Integral multiple) होता है। जहां h प्लांक नियतांक है ऐसी कक्षाएं निश्चित होती हैं । इन निश्चित कक्षाओं को स्थाई कक्षाएं (Stationary Orbit) कहते है।
- प्रत्येक कक्षा में ऊर्जा की निश्चित मात्र संग्लन रहती है जिन्हे ऊर्जा स्तर या ऊर्जा कोश कहते है ऊर्जा स्तरों को क्रमशः 1,2,3,4…. या K,L,M,N ….. इत्यादि से व्यक्त करते है ।
- इलेक्ट्रॉन निम्नतम ऊर्जा की कक्षाओं में रहते है । परमाणु की निम्नतम ऊर्जा अवस्था को आद्य अवस्था (Ground State) कहते हैं । जब बाहरी स्त्रोत से ऊर्जा देने पर इलेक्ट्रॉन उत्तेजित अवस्था में आ जाते है और अधिक ऊर्जा की कक्षाओं में चले जाते है । तो परमाणु की इस अवस्था को उत्तेजित अवस्था (Excited State) कहते हैं। और जब बाहर से बहुत अधिक ऊर्जा देने पर इलेक्ट्रॉन परमाणु कक्षाओं को छोड़कर निकाय (System) से बाहर निकल जाते हैं ।
बोर के परमाणु मॉडल के दोष ~ Drawbacks Of Bohr’s Atomic Model
- बोर का परमाणु मॉडल केवल उन्हीं परमाणु या आयनों की व्याख्या करता है जिनमें एक इलेक्ट्रॉन होता है जैसे – He+,Li2+ और Be3+ आदि के स्पेक्ट्रम की उत्पत्ति व उसकी व्याख्या की जा सकी, परन्तु बहु – इलेक्ट्रॉन परमाणुओं व आयनों के स्पेक्ट्रम की व्याख्या करने में बोर का सिद्धान्त असफल रहा।
- उच्च विभेदन क्षमता (Resolving Power) के स्पेक्ट्रोस्कोप द्वारा जांच करने पर ज्ञात हुआ कि हाइड्रोजन के प्रकाशीय स्पेक्ट्रम में जो एकल रेखा (Single Line) प्रकट होती है वे वास्तव में सूक्ष्म रेखाओं के समूहों से बनी हुई है। बोर का सिद्धान्त स्पेक्ट्रम रेखाओं के सूक्ष्म संरचना की व्याख्या करने में असफल रहा ।
- प्रयोगों द्वारा यह ज्ञात हुआ कि जिस वस्तु से विकिरण का उत्सर्जन हो रहा है उसे चुम्बकीय क्षेत्र में रख देने पर उसकी स्पेक्ट्रम रेखाएं विभक्त हो जाती हैं। इस प्रकार हुए स्पेक्ट्रम रेखाओं के विघटन को जीमान – प्रभाव कहते हैं। बोर के सिद्धान्त द्वारा जीमान – प्रभाव की व्याख्या नहीं की जा सकती है।
- इस मॉडल द्वारा किसी अणु में आबन्ध के निर्माण को नहीं समझाया जा सका ।
- इलेक्ट्रॉन में छोटे कणों के साथ – साथ तरंग गुण भी पाया जाता है। इसकी व्याख्या यह मॉडल नहीं करता है।