रदरफोर्ड का परमाणु मॉडल को समझने से पहले हम परमाणु को समझते है कि परमाणु क्या है ?
किसी पदार्थ का वह छोटा-से-छोटा कण जो किसी रासायनिक अभिक्रिया में भाग ले सके अथवा रासायनिक अभिक्रिया द्वारा अलग किया जा सके, उस कण को परमाणु (Atom) कहते हैं।
उदाहरण : हाइड्रोजन (H), नियॉन (Ne), आर्गन (Ar), लोहा (Fe), कैल्शियम (Ca) आदि ।
रदरफोर्ड का परमाणु मॉडल ~ Rutherford’s Atomic Model
सन् 1911 में अर्नेस्ट रदरफोर्ड ने एल्फा कण प्रकीर्णन प्रयोग के आधार पर परमाणु मॉडल प्रस्तुत किया तो इस मॉडल के अनुसार –
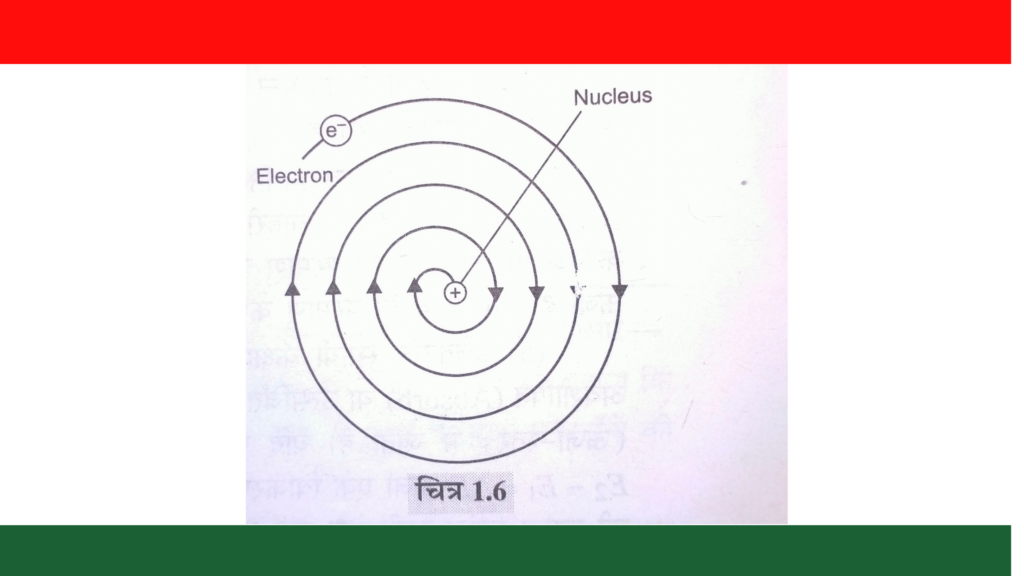
- परमाणु गोलाकार, सूक्ष्म तथा विधुत उदासीन होता है।
- परमाणु दो भागों से मिलकर बनता है।
- परमाणु नाभिक जिसमें सभी धनावेश होता है।
- परमाणु के नाभिक के बाहर का विशाल क्षेत्र जिसमें इलेक्ट्रॉन होते हैं।
- परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर वृत्ताकार पथों में तेजी से विभिन्न कक्षाओं में घूमते रहते है।
- परमाणु में इलेक्टॉनों की संख्या परमाणु नाभिक पर स्थित धनावेश के यूनिटों की संख्या के बराबर होती है । इस कारण परमाणु विधुत उदासीन होता है।
- धनावेशित नाभिक, ऋणावेशित इलेक्ट्रॉनों पर आकर्षण बल आरोपित करता है, परन्तु इलेक्ट्रॉन नाभिक में नहीं गिरते हैं , क्योंकि इलेक्ट्रॉनों के परिक्रमण से उत्पन्न अपकेन्द्र बल नाभिक के आकर्षण बल को सन्तुलित कर देता है।
रदरफोर्ड के परमाणु मॉडल के दोष ~ Drawbacks Of Rutherford Atomic Model
- क्लार्क मैक्सवेल के विधुतगतिकी सिद्धान्त के अनुसार जब कोई आवेशित कण निरन्तर गतिमान अवस्था में रहता है तो ऊर्जा का उत्सर्जन करता है जिसके कारण उस कण की ऊर्जा लगातार कम होती जाती है । इस सिद्धान्त के आधार पर यह निष्कर्ष निकाला जा सकता है कि नाभिक की परिक्रमा करता हुआ इलेक्ट्रॉन निरन्तर ऊर्जा का उत्सर्जन करेगा जिससे उसकी ऊर्जा कम होती रहेगी जिसके फलस्वरूप इलेक्ट्रॉन की कक्षा की त्रिज्जा लगातार कम होती जायेगी और अन्त में इलेक्ट्रॉन नाभिक में गिरकर अपना अस्तित्व खो देगा जिसका अर्थ है परमाणु का विनाश हो जायेगा परन्तु हम जानते है कि परमाणु का विनाश नहीं हो सकता यह एक स्थानी निकाय (System) के स्थायित्व (Stability) की व्याख्या करने में असफल रहा ।
- यदि नाभिक के चक्कर लगता हुआ कोई इलेक्ट्रॉन लगातार ऊर्जा का उत्सर्जन करता है तो परमाणु का स्पेक्ट्रम ( Spectrum) सतत् (Continuous) होना चाहिए अर्थात परमाणु के स्पेक्ट्रम में निश्चित आवृत्ति (Frequency) रेखाएं नहीं होनी चाहिए । परन्तु वास्तव में परमाणु का स्पेक्ट्रम सतत नहीं होता है । उसके स्पेक्ट्रम में निश्चित आवृत्ति की कई रेखाएं होती है। अतः रदरफोर्ड का मॉडल परमाणुओं के रैखिक स्पैक्ट्रम की व्याख्या करने में असफल रहा।
- यह मॉडल परमाणुओं की इलेक्ट्रॉन संरचना ( उनकी कक्षाओं, वेग, ऊर्जा ) की व्याख्या करने में भी असफल रहा ।